ALK基因突变和对应的靶向药物(最全梳理)
% L* L/ i1 j2 l! n$ x3 j& T4 YALK基因突变和对应的靶向药物
5 u8 I5 `1 W( h4 T间变性淋巴瘤激酶(ALK)突变的形式有过量表达、与其他基因形成融合基因,发生点突变等等。ALK基因融合突变是非小细胞肺癌(NSCLC)常见的一种驱动基因,中国非小细胞肺腺癌中ALK融合突变阳性的比例为5.3%,在非小细胞肺腺癌、年轻患者(小于60岁)以及不吸烟的人群中发生率较高,ALK阳性的非小细胞肺癌被认为是一种分子亚型,相对应的靶向药物与EGFR分子亚型完全不同。
+ l* l0 S; w6 Y+ g/ M9 W! hALK融合基因突变主要在肺腺癌里常见,一般肺鳞癌患者ALK融合基因突变概率很低,有报道说1400个肺鳞癌患者里ALK融合基因的发生率为1.3%。考虑到ALK总体突变频率仅有5%,所以对于鳞癌患者也是可以做一下ALK检测的。由于非小细胞肺癌里的驱动基因突变一般是互相排斥的,或者说一山不容二虎,癌细胞也没有必要搞两个驱动突变。有研究说亚裔的EGFR、KRAS野生型的腺癌患者,ALK阳性比例高达30%-42%,因此如果发现EGFR和KRAS是野生型,是更有必要测下ALK基因的。
" l; p, K: M9 n+ O( c4 w1
4 |4 O: c% Q) a, Z6 k5 N! f7 tALK融合突变的检测
, _& C# t. ~6 S q6 l
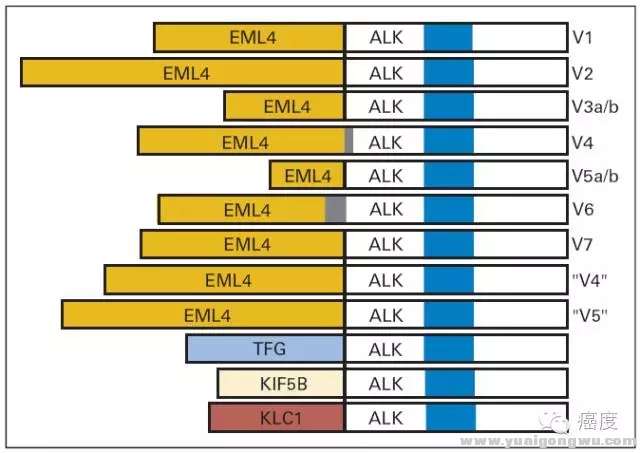 : t% Q* n5 s' @" p' ~. N- U
: t% Q* n5 s' @" p' ~. N- U
图1:非小细胞肺癌中ALK的重排形式3 l5 d4 R- v; j" e+ E0 p& `
据报道,目前已发现21种EML4-ALK的融合形式,另外ALK还可能与TFG、KIF5B、KLC1、PTPN3、STRN等基因发生融合,因此ALK融合突变的诊断是存在一定难度的。下表是关于ALK融合突变的诊断方法,及其相应的特点。* q {, z# A9 ?6 }: Q" P
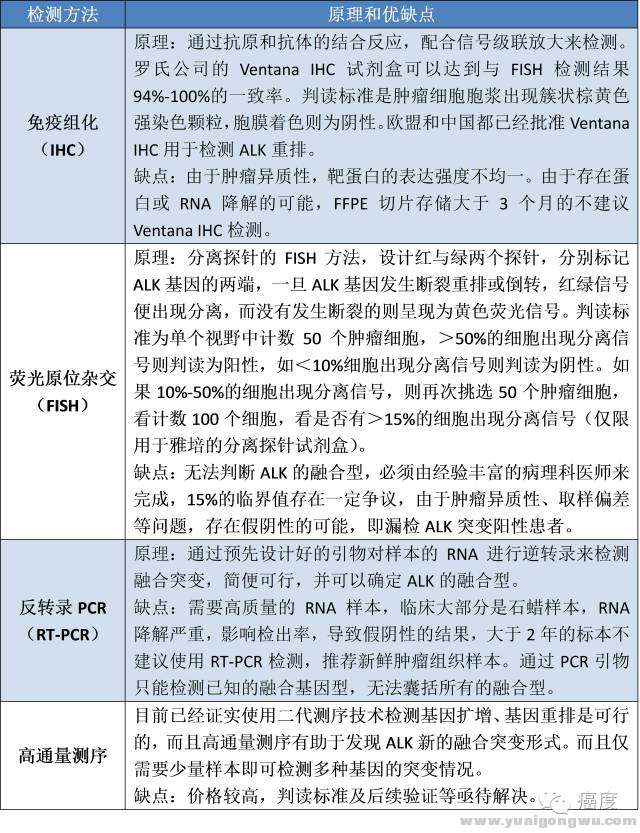
5 G, t/ X5 @# L# c8 Z5 H' a: v( B表1:ALK基因检测的方法
+ G' Q, L$ ]% d' }: [+ [需要注意,临床常用的三种方法是FISH、Ventana IHC及RT-PCR,三种方法FISH的灵敏度最低。因此,如果是胸腔积液、细针穿刺取到的细胞学样本做成的蜡块,不建议使用FISH,避免假阴性。另外通过抽血检测循环肿瘤DNA(ctDNA),循环肿瘤细胞(CTC)也正在发展起来。总之在面对ALK检测结果模棱两可的时候,一定要换一个检测方法去验证,也没有哪一种方法灵敏度和特异性都是100%。( `1 q5 l( ?/ I' p
2# z* o7 ?; m7 P* j& A
ALK的靶向药物# ]1 {- E/ t! D7 s) y) n
ALK融合突变阳性的患者使用克唑替尼可以获益,克唑替尼具有ALK、c-MET、ROS1三个靶点。克唑替尼治疗ALK阳性的非小细胞肺癌客观缓解率达60%,无进展生存期为8-10个月,显著改善并延长的总生存期。需要注意的是,克唑替尼的赠药政策与其他靶向药物不同,第一年买四个月赠八个月,第二年仍需要买四个月,才能终身获赠,合计下来得几十万,价格相对较高,所以使用之前一定明确是ALK突变才行。
$ o, Q- ?) A5 j1 {% Q! [1 a
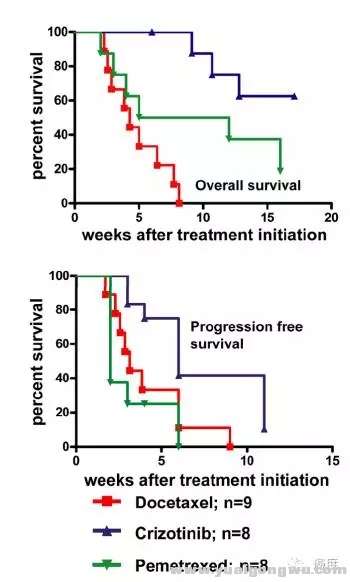 5 z$ W1 _* u5 j0 n& ^
5 z$ W1 _* u5 j0 n& ^
图2:相比多西他赛、陪美曲塞,ALK阳性的肺癌患者使用克唑替尼获益明显。3 L4 m' L$ U O/ c
不管如何,靶向药物都有一个短板就是耐药,使用克唑替尼的患者往往在1-2年内出现对克唑替尼的耐药,以中枢神经系统的复发进展较为常见。$ \1 |. E$ ]2 N/ \8 C/ ]# z
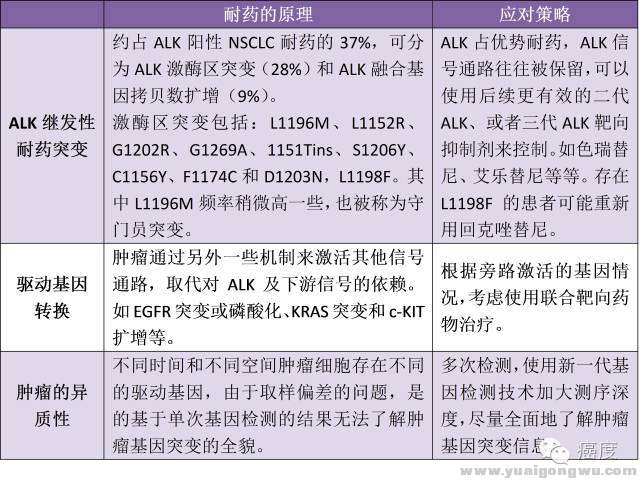 7 ^( B t* s3 |( P
7 ^( B t* s3 |( P
表2:ALK耐药的原因和应对策略2 p! r8 R4 x/ I* X
ALK靶向药物
2 ^3 Q. M* e6 N
9 c* a" o% X" _克唑替尼耐药后,后续还有二代,三代的ALK抑制剂,最近的发现三代ALK抑制剂劳拉替尼(3922)耐药后,患者如果是存在L1198F导致的耐药,可以可以重新用回克唑替尼。几种二代、三代ALK靶向药物的简介如下:7 ~1 S! [/ |3 r8 s
1" |! \% Z3 o! E$ q
艾乐替尼(Alectinib,代号CH5424802)8 Q8 ?& v4 H$ K. E8 g( }8 ?2 q
效率比克唑替尼强10倍,可对抗大多数的ALK激酶区突变,且对脑病灶控制较好。日本的一项临床研究使用的计量为每次300mg、每日两次,46名患者的43名获得客观缓解(客观缓解率达93.5%),日本已经批准了该药使用,美国FDA也已经批准该药用于克唑替尼治疗后耐药的患者。2016年ASCO会议上报道了一项研究,艾乐替尼一线治疗ALK阳性非小细胞肺癌中的无进展(PFS)显著优于克唑替尼。克唑替尼的中位PFS为10.2个月,而艾乐替尼的中位PFS要大于20.3个月。相比克唑替尼,艾乐替尼使得疾病恶化或死亡风险显著降低66%。 B- e( Z3 |1 q$ ?, N9 i
23 X( \ b+ A. }' S" G6 r6 s7 f, g
色瑞替尼(Ceritinib,LDK378)6 Q. P5 B# r7 Q) e1 b! f
对C1156Y具有良好的活性,该药的最大耐受计量为每天750mg,亚裔人的耐受计量可能到不了那么高,又说600mg的。79例克唑替尼耐药的ALK阳性非小细胞肺癌使用该药后,ORR为57%。一项涵盖114名患者的临床表明色瑞替尼的中位PFS为8.6个月。最常见的副作用是恶心、腹泻、呕吐和乏力。有患者反映色瑞替尼的副作用非常大,很少有人耐受,但是如果撑过去了则可能获益期较长。
! g4 |3 d8 \/ B3 p5 ?8 H7 h* S3+ y0 `* t% U' O+ @- x9 p6 W
Brigatinib(AP26113)
) Y5 M2 ^% G* s3 B' h* y# ^一种新型的ALK和EGFR双重抑制剂,可强效抑制ALK的L1196M突变和EGFR的T790M突变。2016年ASCO会议上公布的一项研究结果,即将患者1:1随机分为两组,A组患者每天口服Brigatinib药物90mg,B组患者前7天每天口服Brigatinib药物90mg,后面加量到180mg,两组人群的ORR分别为46%/54%,A组有一例证实的完全缓解,B组有五例证实的完全缓解,中位PFS分别为8.8个月/11.1个月。证明了该药良好获益。6 m* b+ |- V0 P: P( [7 v
4" }8 u) Y& x' h8 f6 ~
劳拉替尼(Lorlatinib,PF06463922)
; J. r3 j* d/ `4 ^该药应该算是第三代ALK抑制剂,可抑制克唑替尼耐药的9种突变,具有较强的血脑屏障透过能力,入脑效果较强,特别适合对其他ALK耐药的晚期NSCLC患者。2016年6月5日,辉瑞在ASCO会议上公布了该药的I/II期临床研究数据,入组的54例患者有41例为ALK阳性,12例为ROS阳性,其中39例有脑转移。该临床试验最终确定的给药方案为每日1次100mg,患者的总应答率为46%,3例实现完全应答,16例实现部分应答,中位PFS为11.4个月,另外还显示出缩小转移性的脑部肿瘤体积的效果。
' _8 V0 u$ G: M另外还有几个药物如X-396,ASP3026等,其相应的靶点和相关数据见下图,如有兴趣的可以追溯相关参考文献进行延伸阅读。
9 I# i7 X/ F4 e) v
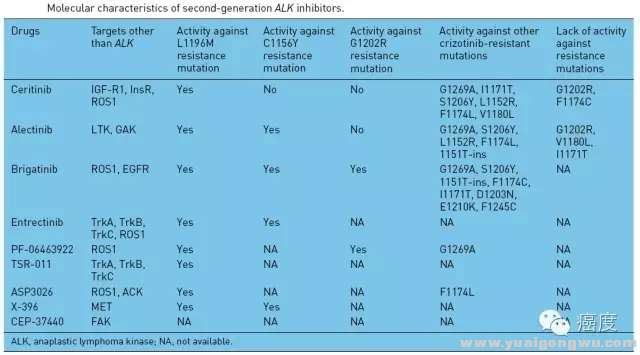 4 d% Y( _+ K6 H, O
4 d% Y( _+ K6 H, O
图3:ALK新一代抑制剂的特点,最后两列为可以克服的克唑替尼耐药位点,以及无能为力的位点。
7 K0 V/ {% H! P. ~: P! C! }3
9 E$ C+ w" i9 zHSP90抑制剂与ALK耐药
" V9 b5 p4 m- m& a0 }1 U9 m联合热休克蛋白(HSP90)是一类称为“分子伴侣”的蛋白质,可帮助新合成的蛋白质形成发挥他们特定生物学功能的正确形状。体外细胞系研究发现HSP90抑制剂Ganetespib对ALK阳性的细胞系有活性,且不管是否经过克唑替尼处理都是如此(见下图)。我们可以看到突变的EML4-ALK和HSP90是需要相互结合的。目前有关HSP90抑制剂Ganetespib的临床试验正在进行中。3 P! _; V8 |+ s4 _5 ^* v, p- v
另一种HSP90抑制剂是AUY922,目前正在进行ALK阳性的NSCLC的II期临床试验,每周计量70mg/平米。疾病控制率为59%(未经克唑替尼治疗的控制率为100%,克唑替尼耐药组的为36%)。2 v& i- ], { ^8 f/ l; ?) J
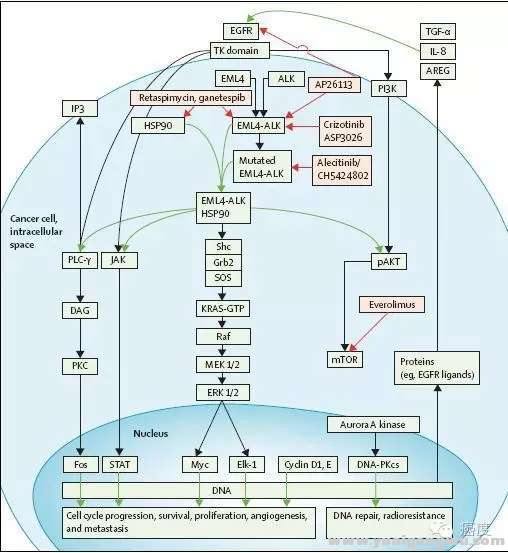 ; @0 `1 ]9 M! Q9 O- D: V% ^
; @0 `1 ]9 M! Q9 O- D: V% ^
图4:ALK阳性NSCLC的靶向治疗机制& G. j) k1 g. V' M
4
, j7 K& Z* u8 Q/ u' S$ IEGFR和ALK双突变患者
/ o( Q# t5 @; v! F: H: @普遍认为,ALK和EGFR基因是互斥的,因为肿瘤其实没有必要制造两个驱动基因。但是对于后期经过多种治疗后,反复耐药的患者。EGFR和ALK共存的概率也不容忽视。对于这一部分患者,联合使用EGFR和ALK的抑制剂较好,比单独使用一种起到更好的控制作用,但是联合治疗副作用会较大,也需要看患者的耐受情况。目前关于两类靶向药物联用效果、副作用等还缺乏数据。当然这部分患者可以考虑下Brigatinib(AP26113),该药是ALK和EGFR双靶点的抑制剂,可以考虑参加入组试验等。但问题是该药可以抑制EGFR和ALK守门员突变(T790M,L1196M),如最开始就使用Brigatinib,这可能是把最后一张牌给打了。6 m% Q7 _3 g6 ?+ S0 @7 G! d3 O. k7 }
笔者曾见过一个原发性双突变的患者,同时具有EGFR和ALK阳性,该患者的治疗情况也将及时追踪,后续再和大家呈报。
; w" f- F P" W- K9 y56 [: Z F1 L1 ~* E E
什么时候停药9 _. U, D' O6 l; J8 Q; A! k5 v* a
即便是出现局部进展,也不是立刻停止克唑替尼等靶向药物的理由,因为可能还有很多癌细胞被药物所抑制。立即停止靶向药物,会导致肿瘤的爆发性进展。
# p+ }0 j5 X2 J0 e4 q5 \, a一项关于使用克唑替尼抑制ALK阳性非小细胞肺癌的研究发现,克唑替尼治疗进展后,继续使用克唑替尼相比停止克唑替尼的患者获益更好。6个月总生存率为76.3% vs 31.2%,1年总生存率为64.7% vs 32.9%,OS为16.4个月 vs 3.9个月。
6 w, C/ S( ?+ i5 v! [也有部分患者使用克唑替尼后,肿瘤病灶快速消失掉了,于是患者把药给停止了,后来导致报复性的复发,有些患者再用克唑替尼也控制不了,即是一种脱靶效应,虽然这其中的机理不知道,但是确实是存在的。这些现象是某些患者的血泪教训,虽然没有临床数据,但值得警惕。因为CT看不到肿瘤了,不代表肿瘤细胞完全被杀灭干净了。停药是一个非常谨慎的事情,望广大患者和家属慎之再慎。
" D( x2 a# e. K) @) ~65 {: P7 S, L3 z! z) \3 S
完美的闭环?
2 C3 p/ e$ e7 @: X( G劳拉替尼(Lorlatinib,PF06463922)被作为ALK靶点的最后一张王牌,因为克唑替尼耐药的所有位点该药似乎都能克服。直到出现了L1198F。新英格兰医学杂志报道了一名患者治疗经过(见下图)。该患者首先使用克唑替尼,耐药后检测发现了C1156Y,但是这个患者对二代ALK抑制剂没有应答,不得已使用劳拉替尼,但是后面新出现的L1198F导致对劳拉替尼耐药,看似山穷水尽,却不曾想L1198F突变导致了与克唑替尼结合更好,逆转了C1156Y的作用,患者对克唑替尼重新复敏。- v b& {8 R8 x& b4 }5 t( F0 q
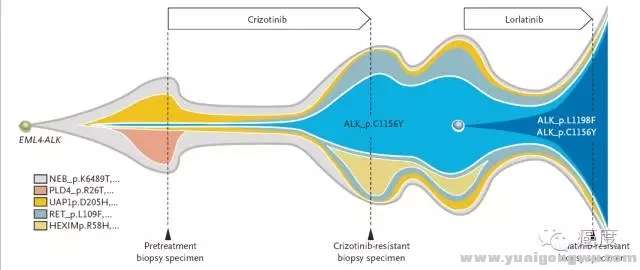
2 v+ [6 \. h% M% Y, p! m图5:L1198F导致的劳拉替尼耐药对克唑替尼重新复敏
; G' O2 h( Y) [这是一个非常有意思的发现,即劳拉替尼这个药物也不是最后的一张牌,这个药物耐药了,也许之前被放弃的药物仍可以有效。所以也有说法ALK是一种钻石突变。但需要谨慎的是不是每一个劳拉替尼耐药的患者都这样。我们从图示看出患者同时存在C1156Y和L1198F突变,才造成了这种逆转。也许其他的突变位点如L1196M等和L1198F就没有这种协同效果。或者还有可能劳拉替尼耐药的原因是其他的旁路激活,如KRAS或EGFR等,具体的还是可以根据基因检测结果来谨慎分析和对待,不过现在的测序技术抽血测ctDNA检测ALK的这些激酶突变总可能会有阴性,ArmsPCR等检测方法也还没有相应的产品,暂时只能尽量地取耐药后的新发组织样本,进行二代测序检测。
: {& k0 E2 |% X( U参考文献:
: Q4 @' {3 N5 a$ \3 T; R5 E9 @9 T1、冯勤 杨欣 林冬梅,ALK阳性非小细胞肺癌的诊断,中国肺癌杂志2 0 1 5年2月第1 8卷第2期。9 f6 }/ s: c8 B& P+ r/ ]; v: f! v
2、蒋涛 周彩存,中国肺癌杂志2015年2月第1 8卷第2期
; B* f9 f) S( b H. t/ x3、Alice T, J Clin Oncol. 2013 Mar 10; 31(8): 1105–1111& ~+ f, o( j" t! |# x
4、Clin Cancer Res. 2014 March 1; 20(5): 1204–1211 \) l9 F/ ]7 u2 h6 H, [8 s& R
5、Ou SH , et al. Ann Oncol, 2014, 25(2): 415-422.: [* @6 s) m [) W C
6、Zhang I,Lancet Oncol. 2015 Oct;16(13): e510-21& U( o C, C7 m% u' Q8 ~2 d
7、Ther Adv Med Oncol. 2016 Jan;8(1):32-472 ]6 i- ~: K& A2 I" e `7 `
8、Shaw AT et al, N Engl J Med. 2016 Jan 7;374(1):54-61 |